Antikörper sind zentraler Bestandteil des menschlichen Immunsystems. Die Proteine dienen dazu, eingedrungene Antigene oder beschädigte Zellen abzufangen und sie so daran zu hindern, mit den Körperzellen zu interagieren oder in die Zellen einzudringen. Diese zentrale Funktion von Antikörpern hat die pharmazeutische Entwicklung dazu inspiriert, mithilfe molekularbiologischer Methoden sogenannte therapeutische Antikörper zu entwickeln. „Vor allem im Bereich der Onkologie und jüngst auch in Zusammenhang mit der Therapie gegen SARS-CoV 2 kommen immer häufiger therapeutische Antikörper zum Einsatz“, erklärt Klaus Liedl. Der Universitätsprofessor am Innsbrucker Institut für Allgemeine, Anorganische und Theoretische Chemie beschäftigt sich gemeinsam mit seiner Mitarbeiterin, Dr. Monica Fernández-Quintero, und einem größeren Forschungsteam mit der Weiterentwicklung und dem Design von therapeutischen Antikörpern.
Hoffnungsträger der Medizin
„Da Antikörper Proteine sind, enthalten sie per se keine toxischen Bausteine, auch ihre Verweil- und damit Wirkdauer im Körper ist länger als bei klassischen Medikamenten aus kleinen chemischen Verbindungen. Zudem können sie durch die molekularbiologische Auswahl relativ einfach für die Anwendung bei verschiedenen Krankheiten hergestellt werden“, beschreibt Klaus Liedl die Vorteile. Anders als klassische chemische Wirkstoffe können sie allerdings nicht oral eingenommen werden, sondern müssen gespritzt werden, um ans Ziel ihrer Wirkung zu gelangen.“ Auch wenn die Herstellungs- und Behandlungskosten für diese Form von Medikamenten noch sehr hoch sind, überwiegen aufgrund des möglichen zielgenauen Designs und der guten Verträglichkeit – vor allem im Bereich der Onkologie – klar die Vorteile, weshalb die pharmazeutische Industrie mittlerweile gleich viel Umsatz mit Biologicals macht wie mit herkömmlichen Medikamenten.
Das Design der therapeutischen Antikörper ist für ihren Einsatz dabei wesentlich, denn nur wenn sie optimal an das für ihre Wirkung vorgesehene Antigen binden, können sie ihre gewünschte Wirkung entfalten. Krankheiten bei denen man bereits sehr gute Erfolge mit therapeutischen Antikörpern erzielt hat, sind diverse Krebsarten, wie Brust- oder Darmkrebs sowie Autoimmunerkrankungen und Erkrankungen des Zentralen Nervensystems. „Bis jetzt hat man therapeutische Antikörper für Krankheiten entwickelt, deren Angriffspunkte an der Zelloberfläche liegen – die also gut für die Antikörper erreichbar sind. Um das Behandlungsspektrum auszuweiten, müssen die Antikörper auch in die Zelle oder in das Zentrale Nervensystem eindringen können“, erklärt Klaus Liedl. Hier kommt allerdings ein Nachteil der Antikörper ins Spiel: Es handelt sich dabei um relativ große Moleküle.
Vorbild aus der Natur
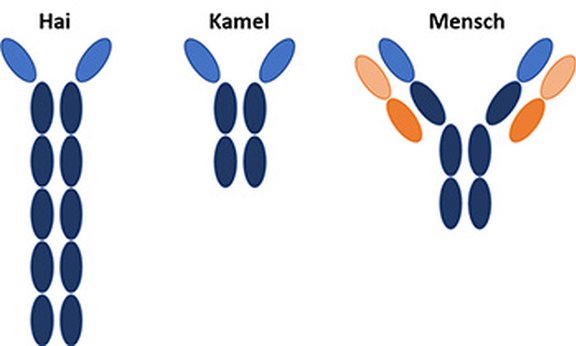
In zwei voneinander völlig unabhängigen Fällen hat die Natur bereits viel einfachere Antikörper entwickelt: „Antikörper sind sogenannte Multidomänen-Moleküle. Sie bestehen aus mehreren Domänen (siehe Abbildung). Antikörper von Haien und Kamelen sind wesentlich kompakter aufgebaut, als die von Menschen. Vor allem in den Bereichen, in denen sie an das gewünschte Antigen binden sollen, sind sie deutlich kleiner“, erklärt Monica L. Fernández-Quintero. Diese geringere Größe und ihren einfacheren Bauplan machen sich die Wissenschaftler*innen zunutze, um verbesserte therapeutische Antikörper zu entwickeln. „Wir bauen sogenannte Nanobodies nach dem Vorbild dieser Hai- oder Kamel-Antikörper“, beschreibt die Chemikerin den komplizierten Vorgang. Bei der Kombination der einzelnen Domänen gibt es eine Vielzahl an Möglichkeiten, die die Wissenschaftler*innen mithilfe von Graphics Processing Units (GPU) simulieren. Für den durchschlagenden Erfolg ist von essentieller Bedeutung, dass die Forschergruppe in der Lage ist, ihre Rechnersysteme selbst zusammenzubauen und an besonders herausfordernde Problemstellungen anzupassen. „So gelingt es uns, mit vergleichsweise wenig Geld mit Eliteuniversitäten konkurrenzfähig zu sein“, so Liedl. Für das optimale Design der therapeutischen Antikörper spielt auch ihre Flexibilität eine wichtige Rolle. „Das Thema der Proteinflexibilität beschäftigt mich in meiner Arbeitsgruppe schon seit vielen Jahren. Dabei untersuchen wir, sehr vereinfacht erklärt, nicht nur die starre Struktur der einzelnen Proteine. Wir schauen uns auch die Kräfte an, die auf die einzelnen Atome im Protein wirken, und bewegen das Protein in Simulationen entlang dieser Kräfte. Dadurch erhalten wir ein sehr genaues Bild von der Flexibilität des Proteins“, erklärt Klaus Liedl. „Diese Simulationen liefern uns wichtige Hinweise für das optimale Design der therapeutischen Antikörper, denn die Bindeeigenschaften einzelner fast identischer Proteine können sich aufgrund ihrer Flexibilität stark unterscheiden.“
Täuschungsmanöver
Ein weiterer Aspekt, den die Chemiker*innen um Klaus Liedl erforschen, ist die sogenannte Humanisierung der therapeutischen Antikörper. „Bevor therapeutische Antikörper zur Behandlung eingesetzt werden können, müssen wir verhindern, dass der Körper den Antikörper als Hai- oder Kamel-Antikörper identifiziert. Wäre dies der Fall, würde das Immunsystem die Antikörper abbauen, noch bevor sie an das gewünschte Ziel binden könnten“, erklärt Monica Fernández-Quintero. Deshalb verwenden die Wissenschaftler*innen nur den oberen Teil der Hai- oder Kamel-Antikörper – also ihr wesentlich kleineres Binde-Interface – und setzen dieses auf molekularbiologisch veränderte menschliche Antikörper, die dann die weitere Kommunikation mit den Zellen übernehmen. Da dieser Vorgang natürlich auch etwas an den Bindeeigenschaften der Antikörper verändern kann, ist auch er Teil der Forschungsarbeit des Teams um Klaus Liedl. „Wir erforschen im Rahmen unserer Simulationen nicht nur, wie dieser Umbau im Design die Bindeeigenschaften verändert, sondern natürlich auch, wie wir die entsprechenden Veränderungen nutzen können, um die Wirkung der Nanobodies zu verbessern“, beschreibt Liedl. Neben der Grundlagenforschung setzten die Chemiker um Klaus Liedl ihr Knowhow auch im Rahmen verschiedener Kooperationsprojekte mit Pharmaunternehmen ein, denn therapeutische Antikörper sind die Hoffnungsträger der Wirkstoffforschung, davon sind sie überzeugt.
Dieser Beitrag ist in der Oktober-2021-Ausgabe des Magazins „wissenswert“ erschienen. Eine digitale Version ist hier zu finden (PDF).

