Weichtiere sind ein sehr alter Tierstamm, dessen Ursprung über 530 Millionen Jahre bis in das frühe Kambrium zurückreicht. Fossile Befunde zeigen, dass die ersten Weichtiere sich offenbar auf einer Sohle kriechend über den Meeresboden bewegten und dabei mit Hilfe einer Raspel-Zunge Bakterien- oder Algen-Teppiche abweideten: Ein Bauplan und eine Lebensweise, die sich auch heute noch bei vielen modernen Schnecken wiederfindet, die sich als erfolgreichste Vertreter der Weichtiere an fast alle Lebensräume dieser Erde anpassen konnten. Nährstoffe, Mineralien und metallische Spurenelemente können demnach von ihnen nicht nur über die Mundöffnung und die Verdauungsorgane, sondern auch über die Haut aufgenommen werden. „Aufgrund dieser engen Verbundenheit mit dem Untergrund sind Schnecken in besonderer Weise von der chemischen Beschaffenheit und Toxizität des Untergrundes und ihrer Umgebung abhängig“, erklären Prof.i.R. Reinhard Dallinger und Dr. Reinhard Lackner von der Arbeitsgruppe „Ökotoxikologie und molekulare Physiologie“ am Institut für Zoologie. „Man weiß heute zum Beispiel, dass es im Lauf der Erdgeschichte aufgrund supervulkanischer, Jahrtausende andauernder Eruptionsereignisse zu massiven Freisetzungen von Cadmium kam, einem äußerst giftigen Schwermetall, das bereits in geringsten Konzentrationen zellschädigend und krebserregend wirkt.“ Hingegen ist das dem Cadmium chemisch sehr ähnliche Metall Zink von Natur aus in höheren Konzentrationen verfügbar, ist aber gleichzeitig viel weniger toxisch als Cadmium und wird als lebensnotwendiges Spurenelement und Ko-Faktor von allen Organismen benötigt. Für Schnecken beispielsweise ist Zink als Bestandteil des Enzyms Carbo-Anhydrase unentbehrlich für den Schalenaufbau.
Evolutionäre Herausforderung
Um im Lauf der Erdgeschichte zu überleben, waren Schnecken also gezwungen, einerseits Mechanismen zu entwickeln, um das äußerst toxische Cadmium zu entgiften, ohne aber dadurch andererseits den Stoffwechsel des lebensnotwendigen Zinks zu unterbinden. Dies ist deshalb nicht trivial, weil Cadmium und Zink aufgrund ihrer chemischen Ähnlichkeit im Organismus weitgehend dazu neigen, sich mit denselben Bindungspartnern zu verbinden. „Schnecken sind dieser evolutionären Herausforderung begegnet, indem sie in Form der sogenannten Metallothioneine Cadmium-spezifische Entgiftungsproteine entwickelt haben, deren Schwefelatome das Cadmium selektiv binden und dabei aus dem Verkehr ziehen“, sagt Reinhard Dallinger. „Aufgrund der ungewöhnlich hohen Cadmium-Präferenz dieser Proteine wird gleichzeitig vermieden, auch das chemisch ähnliche, aber lebensnotwendige Zink einzufangen.“ Das Zink kann über andere Stoffwechselwege für lebensnotwendige Aufgaben im Organismus verfügbar gehalten werden.
Überlebenskünstler Wegschnecke
Die klare Trennung der Stoffwechselwege für Cadmium und Zink ist also eine der Überlebensstrategien dieser Tiergruppe. Dies gilt auch für die als Gartenschädling bekannte Spanische Wegschnecke (Arion vulgaris), deren Stressresistenz berüchtigt ist und mit der Evolution derartiger Metall-selektiver Stoffwechselwege zusammenhängt. Denn während der Weg des Cadmiums über die Bindung an Metalliothioneine bei zahlreichen Schneckenarten schon länger bekannt ist, wusste man bislang wenig über das Schicksal des Zinks. Dies ist unter anderem auch darauf zurückzuführen, dass das für den Metallstoffwechsel verfügbar gehaltene Zink in Schnecken niedermolekulare Verbindungen bildet, die in der Praxis mit gängigen Verfahren nur schwer zu isolieren sind, und deren Charakterisierung mit herkömmlichen analytischen Methoden bislang scheiterte. Dank einer Kooperation mit der Arbeitstruppe „Umweltphysik“ um Prof. Armin Hansel vom Institut für Ionenphysik und Angewandte Physik ist es den Zoologen kürzlich gelungen, ein Schlaglicht auf diese bislang verborgenen Stoffwechselwege des Zinks zu werfen. „Wir haben am Institut für Ionen und Angewandte Physik zusammen mit der Firma IONICON ein neuartiges Verfahren zur Analyse von niedermolekularen Verbindungen (kleiner 2 kDa) in Flüssigkeiten entwickelt“, erzählt Hansel. Dieses Verfahren wurde nun erstmals für die Analyse der niedermolekularen Zinkverbindungen, die beim Metallstoffwechsel von Schnecken entstehen, mit Erfolg getestet.
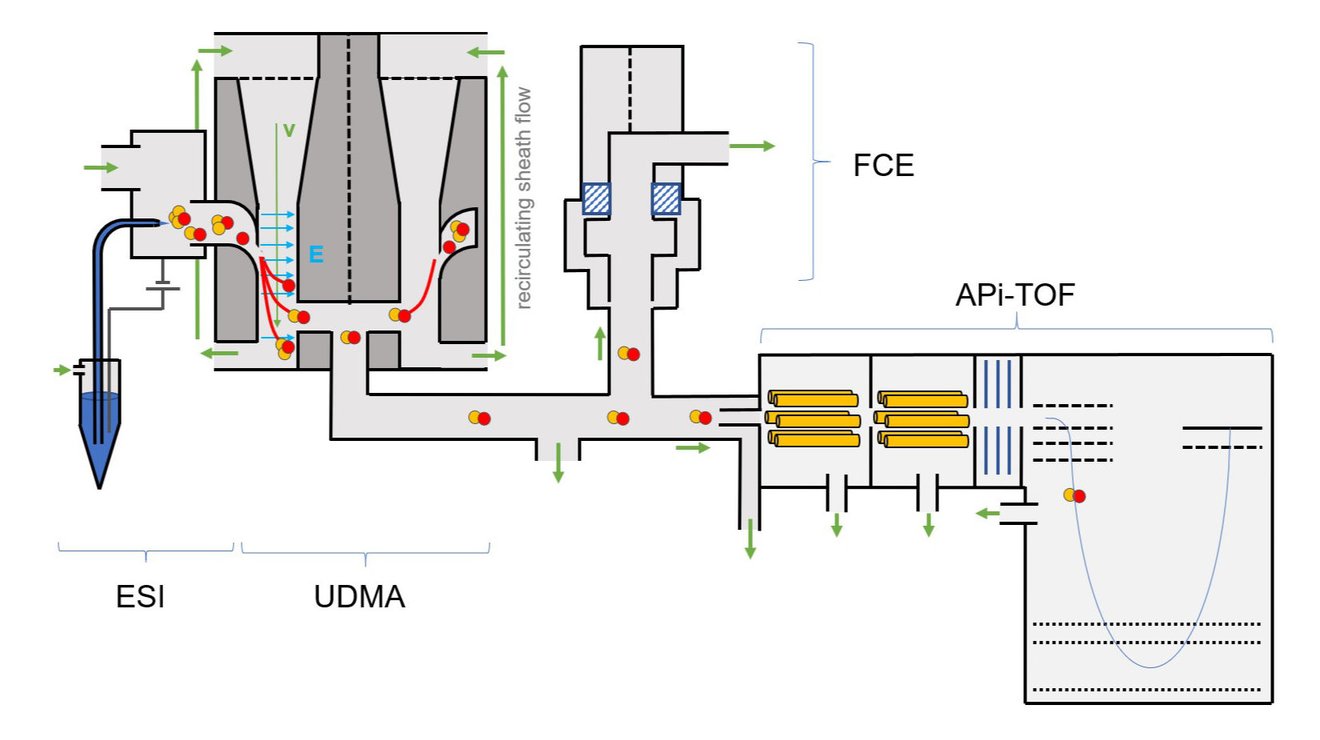
Das vorgereinigte flüssige Extrakt aus dem Gewebe der Schnecken wurde in einer Elektrospray-Ionenquelle (ESI) ionisiert und dann in einem Ionenmobilitätsanalysator (UDMA) der Größe entsprechend getrennt. Die Ionendetektion erfolgte einerseits mit einem Faraday-Cup-Elektrometer (FCE) (Größenbestimmung der ionisierten Verbindungen ohne Fragmentierung) und andererseits mit einem Flugzeitmassenspektrometer (API-TOF). Mit dieser Methode lassen sich für jede Größe der Verbindung getrennt eigene Massenspektren erstellen. Das Massenspektrum bei einem Mobilitätsdurchmesser von 1,62 Nanometer zeigt bei der Muttermasse und einigen Fragmenten charakteristische Isotopenmuster, die die Anwesenheit von Zink in der Verbindung mit der Masse 862 Da bestätigen.
„Vor Beginn der analytischen Untersuchungen haben wir das Problem ausführlich diskutiert, bevor uns klar wurde, dass die am Institut für Ionenphysik neu entwickelte Methode möglicherweise einen neuen Ansatz liefern könnte, um die Frage nach den niedermolekularen Zinkkomplexen bei Schnecken einer Lösung zuzuführen“, erzählt Armin Hansel. „Dank der gelebten Zusammenarbeit zwischen Physik und Zoologie konnte so ein spannendes Kapitel aus der Stoffwechselphysiologie der Metalle geklärt werden.“ Die Ergebnisse wurden vor wenigen Wochen in der Fachzeitschrift „Scientific Reports“ publiziert.
Gefördert wurde die Forschung vom Österreichischen Wissenschaftsfonds FWF (DACH-Projekt No. I 1482-N28, Leading Agency FWF, Projektleiter: R. Dallinger) und FWF Projekt Nr. P27295-N20 Projektleiter: G. Steiner, dem Tiroler Wissenschaftsfonds TWF (nano-TOF-ICE) und einer Promotionsförderung für junge Wissenschaftler der Universität Innsbruck.
Links
- Dvorak, M., Schnegg, R., Salvenmoser, W. et al. Distinct pathways for zinc metabolism in the terrestrial slug Arion vulgaris. Sci Rep 9, 20089 (2019) doi:10.1038/s41598-019-56577-7
- Dvorak, M., Lackner, R., Niederwanger, M., et al. Metal binding functions of metallothioneins in the slug Arion vulgaris differ from metal-specific isoforms of terrestrial snails. Metallomics (2018) 10, 1638
- Leiminger, M., Feil, S., Mutschlechner, P., et al. Characterisation of the transfer of cluster ions through an atmospheric pressure interface time-of-flight mass spectrometer with hexapole ion guides. Atmos. Meas. Tech. (2019) 12, 5231-5246

