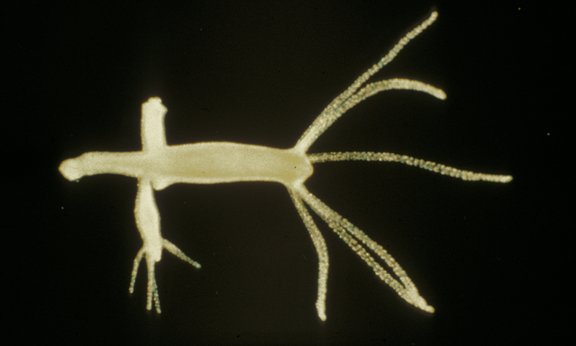
Süßwasserpolypen sind die bisher einzigen als unsterblich geltenden Tiere. Die größtenteils aus Stammzellen bestehenden Verwandten der Qualle bilden aus Knospen neue Polypen, die sich ablösen und selbst zu einem vollständigen Tier heranwachsen. „Durch asexuelle Vermehrung und die erstaunliche Eigenschaft der Hydren, sich vollständig regenerieren zu können, wachsen laufend identische Süßwasserpolypen heran“, erklärt Bert Hobmayer, der betont, dass auf diese Weise der Vermehrung auch die Erbinformation aller Hydren in einer Kulturschale identisch ist. Durch ständige Regeneration der Stammzellen erneuern sich die 0,5 bis 1 Zentimeter kleinen Tiere ständig selbst. „Im Labor arbeiten wir mit Tieren, die bereits in den 60er Jahren als Labortiere etabliert wurden und sich seither asexuell fortpflanzen“, so der Zoologe. Die erstaunliche Regenerationsfähigkeit geht sogar soweit, dass die Hydren in lebende Zellen zerlegt werden können, und durch Zellsuspensionen und daraus entstehenden Zellklumpen wieder vollständige Polypen werden. „Nur etwa 500 bis 1000 Zellen reichen aus, um in Selbstorganisation, in etwa zwei Wochen, wieder einen völlig intakten Süßwasserpolypen hervorzubringen. Für ein Tier, das bereits ein Muskel- und Nervensystem hat, ist dies eine unglaubliche Leistung. Menschen oder höher entwickelte Wirbeltiere sind von derartigen Funktionen weit entfernt“, so Hobmayer.
Gestalt wird gebildet
Herauszufinden welche Prozesse eine dreidimensionale Gestaltbildung organisieren, ist Ziel von Hobmayer und seinem Team. Auf der genetischen Ebene haben die Wissenschaftlerinnen und Wissenschaftler bereits nach Genen gesucht, die gestaltbildend aktiv sind und die notwendigen molekularen Informationen liefern. „Unser dreidimensionaler Körper ist Ausdruck von Gestaltbildungsprozessen, die in der Embryonalentwicklung ablaufen. Beginnend bei der Befruchtung der Eizelle durchläuft dieser Prozess die typischen Stadien, in denen auch die verschiedenen Territorien definiert werden, die über das zukünftige Schicksal der Zellen entscheiden. In zweidimensionalen Gewebeschichten findet der eigentliche Gestaltbildungsprozess statt“, erklärt der Wissenschaftler, der anschaulich verdeutlicht, dass aus einer zweidimensionalen Gewebefläche, ähnlich einer Tischplatte, an einem Bruch der Symmetrie ein Punkt beginnt, sich nach außen zu wölben. „In der asexuellen Vermehrung der Hydra finden dieselben Ausstülpungsprozesse statt. Aus der Mutter-Hydra bilden sich seitlich an der Körpersäule weitere kleine Polypen, die sich nach einiger Zeit lösen und selbstständig zu einem fertigen Tier heranwachsen“, so Hobmayer. Gemeinsam mit seinem Team konnte der Wissenschaftler bereits molekulare Signale charakterisieren, die die Zellen zur Auswölbung veranlassen und durch die auch die exakte Stelle definiert wird, an der dies passieren wird. Ähnliche Signalwege steuern auch bei Vögeln und Säugetieren das Auswachsen der Extremitäten. „Diese molekularen, theoretischen Signale haben wir bereits untersucht. Jetzt sind wir daran interessiert, wie diese auch mechanisch umgesetzt werden“, konkretisiert der Zoologe.
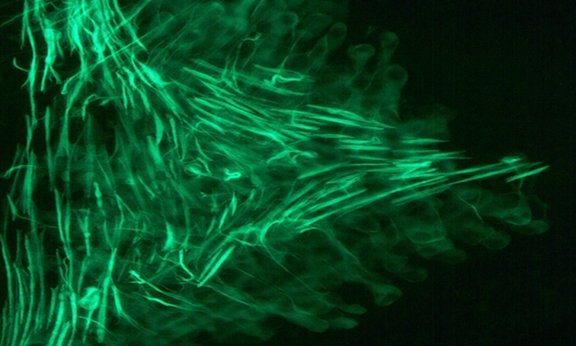
Der Schlüssel
Das Aktin Zytoskelett ist das Gerüst der Zellen und der Schlüssel zur Formveränderung die in den Ausstülpungsprozessen stattfindet. In der aktuellen Ausgabe der Online-Fachzeitschrift „Biology Open“ beschreiben Hobmayer und seine Mitarbeiterinnen und Mitarbeiter nun die Veränderungen des Aktin Zytoskeletts, die zur asexuellen Knospenbildung von Hydra beitragen. „Nicht statisch, sondern dynamisch gibt das Aktin Zytoskelett den Zellen seine Struktur. Es gibt genügend Freiraum, damit sich die Zellen bewegen, strecken, die Form verändern oder sogar wandern können“, verdeutlicht Hobmayer. Dieselbe Struktur lässt sich auch in den Muskeln des Menschen finden, die auch durch Strecken oder Kontraktion die Bewegung umsetzen. Zur Beobachtung des Zytoskeletts wurde bisher das stark an Aktin bindende Protein Phalloidin und ein daran gekoppelter fluoreszierender Farbstoff verwendet. So wurde das Aktin Zytoskelett unter dem Mikroskop sichtbar. „Das Phalloidin, ein Eiweiß und Giftbestandteil des Knollenblätterpilzes, bindet an die Aktinfilamente und verursacht den Verlust der muskulären Bewegungsfähigkeit. Allerdings konnte damit das Aktin Zytoskelett bisher nur an totem Gewebe beobachtet werden“, erklärt der Zoologe. Eine Gruppe am Max Planck Institut in München hat an diesem Problem gearbeitet und ein neuartiges Eiweiß aus Hefezellen charakterisiert, das genauso effektiv an Aktin bindet wie Phalloidin, ohne aber die Kontraktionseigenschaften des Aktin Zytoskeletts zu verändern. „Dank dieses Hefeeiweißes, genannt Lifeact, ist es nun möglich, das Zytoskelett auch an lebenden Tieren zu beobachten“, freut sich der Wissenschaftler, der schon früh die Lifeact-DNA-Sequenz zur Verfügung gestellt bekommen hat, sie mit der DNA-Sequenz eines fluoreszierenden Proteins koppeln konnte, und dessen Doktorand Roland Aufschnaiter in der Lage war, dieses künstlich hergestellte Gen in das Genom der Hydra einzuschleusen. „Durch Mikroinjektionen der im Labor zusammengebauten DNA in die einzelligen Embryonen der Hydra wird dieses, mit einer gewissen statistischen Häufigkeit, in das Erbmaterial des Tieres eingebaut“, erläutert Hobmayer. Durch die Vervielfältigung der Zellen während der Embryonalentwicklung der Hydra wird auch die Fremd-DNA im gesamten Körper verteilt und jede einzelne Zelle prägt nun das an Aktin bindende und fluoreszierende Eiweiß selbst aus. Betrachten die Wissenschaftlerinnen und Wissenschaftler die Hydren unter dem Fluoreszenzmikroskop, dann leuchten sie und machen das Aktin Zytoskelett im lebenden Tier sichtbar. „Hat man diese Linie der Hydra einmal produziert, dann kann sie über asexuelle Vermehrung unendlich vervielfacht werden, und lauter wiederum identische Tiere entstehen“, erklärt der Zoologe.
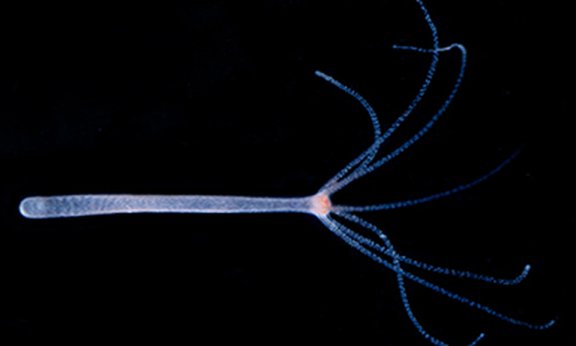
Wandernde Zellen
Hobmayer und sein Team wollen verstehen, wie Gestaltbildung biomechanisch funktioniert und was die Zellen genau machen. „Uns interessiert nicht nur die abstrakte molekulare Information, sondern wir wollen wissen, wie die Zellen diese konkret umsetzen, welche Formveränderungen sie machen, wie sie ihr Zytoskelett dynamisch verändern und wie Formbildung funktioniert“, ist der Zoologe neugierig. Durch das Lifeact wird das Muskelsystem der Hydra unter dem Lichtmikroskop sichtbar. „Unter einem speziellen Mikroskop konnten wir an lebenden Tieren beobachten, wie sich aus einem Mutterpolypen kleine weitere Polypen herausbilden. So wurde der gesamte Prozess innerhalb eines Tages, von der Veränderung der Muskelfortsätze über die Formveränderung der Zelle und ihre Bewegungen, für uns sichtbar“, ist Hobmayer begeistert. Diese Beobachtungen lassen den Wissenschaftler darauf schließen, dass die Zellen im Lauf dieses Prozesses selbst aktiv werden und sie durch Kontraktionen ihrer Muskelfortsetze zu wandern beginnen. „Diese Eigenbewegung der Epithelzellen hat uns sehr überrascht. Sobald die Knospe beginnt, den kleinen Polypen zu bilden, scheinen die Zellen selbst in diese Richtung zu wandern und schieben den Prozess wortwörtlich an“, so der Wissenschaftler, der vermutet, dass von der Spitze der Auswölbung ein Signal ausgesendet wird, das die Zellen dazu veranlasst, ihm zu folgen und nachzuwandern. Die von Hobmayer und seinem Team gezogene Lifeact-Linie der Hydra kommt aktuell bereits in Forschungsprojekten in den USA, Israel, Deutschland und Italien zum Einsatz. „In unseren Forschungsarbeiten haben wir den großen Vorteil, dass wir international mit den identischen Tieren arbeiten und so unsere Forschungsergebnisse extrem gut vergleichbar sind. Unsere Forschung ist auch mit einem Doktoratskolleg an der Uni Innsbruck vernetzt, in dessen Rahmen die Regeneration und das Altern erforscht wird“, schließt Hobmayer. So liefern die kleinen unsterblichen Hydren ein komplexes Forschungsfeld, in dem noch viele offene Fragen zu klären sind.
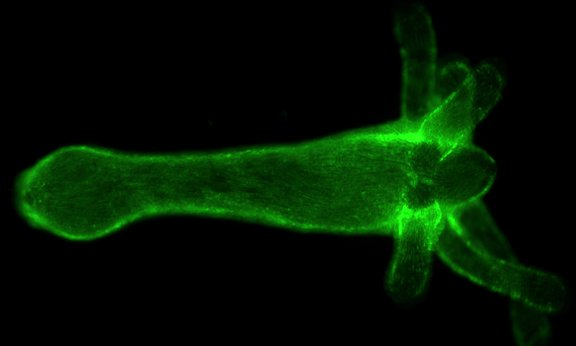
Publikation
Apical and basal epitheliomuscular F-actin dynamics during Hydra bud evagination
Roland Aufschnaiter, Roland Wedlich-Söldner, Xiaoming Zhang, Bert Hobmayer
Biology Open 2017 6: 1137-1148; DOI: 10.1242/bio.022723