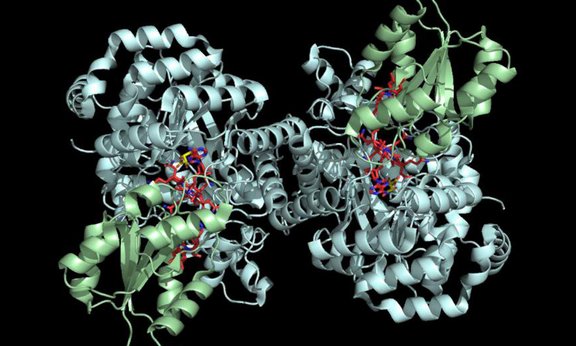
Mit der Radikalkatalyse hat die Natur einen Weg gefunden, wichtige, nur wenig reaktive organische Moleküle, wie Methan, für sich nützlich zu machen. Dafür werden sehr reaktive und oft aggressive Radikale eingesetzt. Diese Radikale dürfen allerdings erst dann in der Zelle auftreten, wenn sie auch wirklich für den zellulären Metabolismus benötigt werden und das Substrat für die Radikalreaktion im Enzym bereitgestellt ist. Sonst würden die Radikale auf unerwünschte Weise und zerstörerisch wirken. Im Menschen, der Vitamin B12 mit der Nahrung aufnehmen muss, ist es das B12-abhängige Radikal-Enzym Methylmalonyl-CoA Mutase, das für den kompletten Fettsäureabbau wichtig ist. Ein verwandtes, in Bakterien wichtiges, Enzym ist die Glutamat-Mutase, die ebenfalls das Co-Enzym B12 für seinen Katalyse-Prozess benötigt. Die für die Glutamat-Mutase wichtigen Schritte bei der Radikalkatalyse mittels des Co-Enzyms B12 haben Bernhard Kräutler vom Institut für Organische Chemie und dem Centrum für Molekulare Biowissenschaften der Universität Innsbruck und Forscher um Karl Gruber und Christoph Kratky vom Institut für Molekulare Biowissenschaften der Universität Graz nun genau aufgeklärt.
„Gezähmte“ Radikale
Wie schon länger etabliert, wird das Co-Enzym B12 für die Radikalkatalyse an seiner schwachen Kobalt-Kohlenstoff-Bindung in ein sehr aggressives Adenosyl-Radikal und eine stabile Kobalt-Verbindung aufgespalten. Die Forscher aus Innsbruck und Graz haben nun röntgenkristallografische Untersuchungen an der Glutamat Mutase mit zwei genau konstruierten, synthetischen Varianten des Co-Enzyms B12 durchgeführt. Mit diesem Ansatz konnten sie nun zeigen, wie genau das Co-Enzym B12 im Enzymprozess gespalten wird und warum die dabei entstehenden Radikale nur ihre hochkontrollierte und sehr gezielte Wirkung haben. Es gelang ihnen abzuleiten, wie das mit seinem Substrat beladene Enzym das Co-Enzym B12 im Bereich der schwachen Kobalt-Kohlenstoff-Bindung mittels einer fehlplatzierten Bindungstasche streckt und so die Bindung spaltet. Das so entstandene hochreaktive Adenosyl-Radikal ist in seinem Käfig stark immobilisiert und hat nur den für die Katalyse nötigen Bewegungsspielraum. Die Fixierung im Protein-Käfig gewährleistet also gleichzeitig, dass das Radikal zwar katalytisch nützlich ist, aber keine andere, zellschädliche Prozesse auslöst, eine Strategie, die als „negative Katalyse“ bezeichnet wird. Wie für die echte Katalyse wichtig, ist der gesamte Ablauf reversibel und das Co-Enzym B12 wird nach jedem Katalyse-Durchgang durch Einfangen des Adenosyl-Radikales wieder unverändert zusammengebaut und steht so für den nächsten Katalyse-Zyklus zur Verfügung.
Finanziell gefördert wurden die mehrjährigen Forschungen in Innsbruck vom österreichischen Wissenschaftsfonds FWF. Die hier zusammengefassten Ergebnisse wurden in der Fachzeitschrift Angewandte Chemie International Edition veröffentlicht.