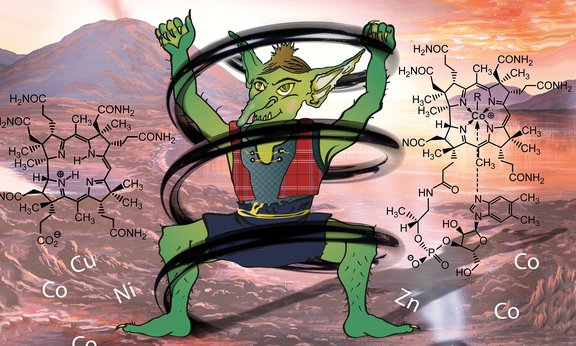
Das Vitamin B12 ist an vielen Prozessen des Lebens beteiligt. Interessanterweise sind nur Mikroorganismen in der Lage, diese biologisch wichtige Verbindung herzustellen, der Mensch muss das Vitamin über die Nahrung aufnehmen. Weil im Zentrum der Verbindung ein einzelnes Kobalt-Ion sitzt, sprechen die Wissenschaftler scherzhalber manchmal vom „Kobold-Vitamin“. Basierend auf Arbeiten der Forschungsgruppe von Martin Warren an der University of Kent mit genetisch modifizierten Mikroorganismen ist es den Chemikern um Bernhard Kräutler vor einigen Jahren bereits gelungen, das Kobalt-Ion durch ein Rhodium-Ion zu ersetzen. Mit ihren Kooperationspartnern konnten sie nun das intakte metallfreie Kernelement der Vitaminstruktur biotechnologisch erzeugen. „Damit wurde ein Traum vieler B12-Forscher war“, freut sich Kräutler, „da diese Verbindung eine ideale Basis für die nun vergleichsweise direkte Synthese von analogen Verbindungen bietet, in welchen andere Metalle anstelle des aktivierten Kobalt-Ions von Vitamin B12 sitzen.“ Solche inaktive ‚Antivitamine B12‘ werden interessante Erkenntnisse über die biologischen Funktionsweisen von Vitamin B12 ergeben.
Spiralförmig umschlossen
Christoph Kieninger, Postdoktorand in der Gruppe von Bernhard Kräutler, ist es erstmals gelungen, die kobaltfreie Grundeinheit von Vitamin B12 zu kristallisieren. Die Innsbrucker Wissenschaftler konnten seine Struktur im Detail analysieren und dabei genau zeigen, wie die Vitamin-Grundstruktur um das Kobalt-Ion herum spiralförmig angeordnet ist. „Die besondere Reaktivität des Vitamins rührt offenbar daher, dass sowohl das Kobalt-Ion wie auch der es bindende helikale Corrin-Ring strukturbedingt unter Spannung stehen. Für seine Stabilisierung und Entspannung im Komplex spaltet das Kobalt-Ion einen oder seine beiden weiteren Liganden leicht ab, was die Katalyse schon entscheidend auf den Weg bringt.“ Bisher wusste man, dass der Corrin-Ring speziell auf die Größe der Kobalt-Ionen angepasst ist. Die genau analysierte, spiralförmige Struktur erwies sich nun als ein wichtiger zweiter Strukturfaktor, der aber speziell der Steigerung der Reaktivität des Kobalt-Zentrums des Vitamins für seine Katalysefunktion dient.
Kobalt im Zentrum
Die Grundstruktur von Vitamin B12 als Kobalt-Corrin dürfte erdgeschichtlich schon sehr früh entstanden und dann von ersten lebenden Organismen genutzt worden sein. Im Laufe der Evolution wurde diese Struktur nur durch einfache Modifikationen in den lebenden Zellen weiter verbessert, wobei sich aber Kobalt als das ideale Katalysezentrum für verschiedene wichtige Lebensprozesse erwiesen hat. Deshalb wurde der resultierende Kobaltkomplex, Vitamin B12, für viele Lebewesen unentbehrlich, so auch für den Menschen. Ob und wie andere Metalle als Kobalt die Aktivität so entscheidend verändern, dass sogar inaktive ‚Antivitamine B12‘ entstehen, will Bernhard Kräutler mit seinem Team nun herausfinden.
Links
- The Hydrogenobyric Acid Structure Reveals the Corrin Ligand as an Entatic State Module Empowering B12‐Cofactors for Catalysis. Christoph Kieninger, Evelyne Deery, Andrew Lawrence, Maren Podewitz, Klaus Wurst, Emi Nemoto-Smith, Florian J Widner, Joseph A Baker, Steffen Jockusch, Christoph R Kreutz, Klaus R Liedl, Karl Gruber, Martin J Warren Bernhard Kräutler. DOI: 10.1002/anie.201904713
- Arbeitsgruppe Kräutler
- Institut für Organische Chemie
- Center for Molecular Biosciences Innsbruck (CMBI)