Schnecken haben im Lauf ihrer Evolutionsgeschichte schon früh die Fähigkeit entwickelt, das toxische Metall Cadmium durch selektive Bindung an ein Entgiftungsprotein gezielt zu entschärfen. Die Struktur und Funktionsweise einer neuartigen, optimierten Variante dieser Giftandockstelle hat das Team Dallingers gemeinsam mit spanischen Kolleg:innen am Beispiel der Riesennapfschnecke (Lottia gigantea) erstmals aufgeklärt. Im Fachjournal Scientific Reports berichten die Wissenschaftler:innen darüber, dass Napfschnecken ihre Entgiftungskapazität mithilfe von Metallothionein-Molekülen gegenüber allen anderen Schneckenarten entscheidend perfektioniert haben, indem sie eine neue Proteindomäne erfunden haben.
Dank des hohen Schwefelgehaltes der Cystein-Aminosäuren in den Metallothioneinen sind diese Biomoleküle in der Lage, Schwermetalle – allen voran Cadmium – besonders stark zu binden und dadurch zu entgiften. Die Bindung erfolgt bei den Metallothioneinen der meisten Schneckenarten in zwei sogenannten „Protein-Domänen“, die locker miteinander verbunden sind und jeweils drei Cadmium-Ionen gleichsam „einpacken“ und dadurch inaktivieren können.
Wie die Forscher:innen am Beispiel von Lottia gigantea zeigen, können Napfschnecken mithilfe einer neu erfundenen Domäne vier anstatt drei Cadmium-Ionen – wie bei allen anderen Schnecken-Metallothioneinen – binden. Das vollständige Protein mit seinen zwei Domänen kann daher insgesamt sieben Metall-Ionen entgiften anstatt sechs, wie dies bei allen anderen Schneckenarten der Fall ist. Die chemische Fachsprache bezeichnet dies als „Erhöhung der Bindungsstöchiometrie“ (von sechs Cadmium-Ionen pro Protein-Molekül auf sieben). Eine weitere evolutionäre Innovation des Metallothioneins der Napfschnecke ist seine besonders starke Cadmium-Bindung. Die Zoologin Veronika Pedrini-Martha vom Team Dallingers erklärt dies so: „Während alle bisher bekannten Metallothioneine das Cadmium bei einem pH-Wert von 3 wieder abgeben, bleibt das Cadmium im Metallothionein von Lottia gigantea auch noch unter extrem sauren Bedingungen von pH 2,4 an das Protein gebunden. Das ermöglicht den Napfschnecken zum Beispiel ein Überleben in der Nähe hydrothermaler Quellen am Grunde der Tiefsee, denn in diesen durch Erwärme erhitzten, sauren Quellen sind sehr viele toxische Metalle, unter anderem Cadmium, gelöst“.
Cluster mit Diamant-ähnlicher Bindungsstruktur
Die bisherigen Ergebnisse lassen laut Dallinger zudem den Schluss zu, dass der Schwefel-Cadmium-Cluster innerhalb der neuen Domäne eine dreidimensionale Struktur hat, die jener des Adamantans gleicht. Das ist eine organische Verbindung, die aus zehn Kohlenstoff- und 16 Wasserstoffatomen besteht, bei der die Kohlenstoffatome gleich angeordnet sind wie in einem Diamantkristall, daher der Name.
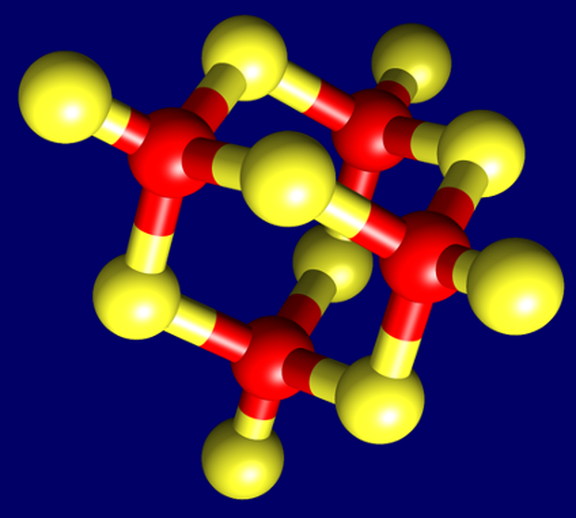
Abgeleitete dreidimensionale Adamantan-Struktur des Cadmium-Schwefel-Clusters in der de novo evolvierten γ-Domäne des Metallothioneins der Napfschnecken. Zehn Schwefel-Atome der an der Bindung beteiligten Cystein-Aminosäuren (gelb) bilden dabei mit vier CadmiumII-Ionen (rot) einen rigiden Schwefel-Metallcluster (Stöchiometrie: CdII4S10).
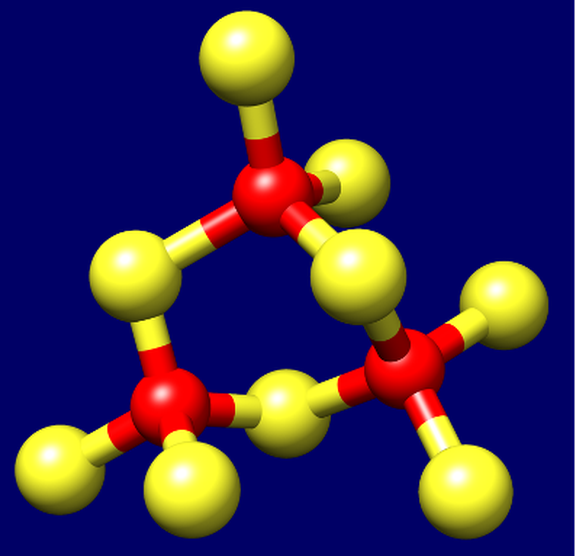
Dreidimensionale Anordnung des Schwefel-Cadmium-Clusters in den konventionellen β-Domänen der Metallothioneine aller übrigen Gastropoden, die mit je neun Schwefelatomen der an der Bindung beteiligten Cystein-Aminosäuren (gelb) und drei CadmiumII-Ionen (rot) eine sogenannte Cyclohexan-Struktur aufweisen (Stöchiometrie: CdII3S9), wie Dallinger in einer seiner früheren Arbeiten bereits zeigen konnte (Dallinger et al. 2001, Eur. J. Biochem. 268, (15), 4126-4133).
Anpassung an extreme Lebensräume
Molekularbiologische Screening-Verfahren der entsprechenden Proteinsequenzen haben das Team zu einer dritten, entscheidenden Erkenntnis geführt: Diese innovative Metallothionein-Variante findet sich nicht nur in der Riesennapfschnecke, sondern auch bei allen anderen Napfschnecken-Arten, deren Sequenzen bisher bekannt sind. „Es handelt sich dabei also um eine evolutionäre Innovation, die für die systematische Ordnung der Napfschnecken (Patellogastropoda) zutrifft“, wie Dallinger, der wissenschaftliche Leiter und Koordinator des internationalen Forschungsprojektes, erklärt.
Napfschnecken haften sich mit ihrem Fuß am Substrat fest und bewegen sich im Lauf ihres Lebens wenig. Dabei raspeln sie Algen und Mikroorganismen vom zumeist felsigen Untergrund ab. Die Riesennapfschnecke beispielsweise lebt in der Spritzwasserzone der nordamerikanischen Pazifikküste und muss mit wechselnden Wasser- und Sauerstoffgehalten, aber auch mit wechselnden Ionen- und Metall-Konzentrationen ihres Lebensraumes zurechtkommen. Ihre Abwehrmechanismen gegen Umweltstress müssen daher besonders gut entwickelt sein“, so bringt der Ökotoxikologe die Überlebens-Strategie dieser Weichtiere auf den Punkt. Die neu erfundene Metallothionein-Variante ist Teil dieser Abwehrmechanismen und erklärt beispielsweise, warum zahlreiche andere Napfschneckenarten in Lebensgemeinschaften rund um - oftmals stark Schwermetall-haltige - Heißwasserquellen in der Tiefsee mit Temperaturen bis zu über 400 Grad Celsius (sogenannte „schwarze Raucher“) besonders gut gedeihen und überleben können.
Evolutionär erfolgreich und ökologisch höchst relevant
Die zu den Weichtieren (Mollusken) zählenden Schnecken sind mit geschätzten 80.000 Arten nach den Gliedertieren die formenreichste Tiergruppe. Sie konnten sich im Lauf der Evolution an unterschiedlichste Lebensräume dieser Erde erfolgreich anpassen. Seit etwa 480 Millionen Jahren verfügen Schnecken über Metall-selektive Entgiftungsproteine und können deshalb in Cadmium-belasteten Lebensräumen existieren.
Die neu erfundene Metallothionein-γ-Domäne der Napfschnecken ist ein „Mechanismus“, der dazu beiträgt, derartige Anpassungen zu ermöglichen. Cadmium und andere toxische Schwermetalle werden dabei in der Mitteldarmdrüse der Schnecken angereichert und mithilfe des neuartigen Metallothioneins entgiftet. „Die Mitteldarmdrüse der Weichtiere ist in ihrer Funktion - vereinfachend erklärt - mit der menschlichen Leber vergleichbar. Und exakt diese Fähigkeit macht Schnecken zu den vielleicht wichtigsten Bioindikatoren für Schwermetallbelastungen in der Umwelt. Weltweit werden sowohl an Land, als auch im Süßwasser und im Meer lebende Schneckenarten in internationalen Biomonitoring-Programmen zum Nachweis und zur Überwachung der Schwermetall-Belastung ihrer Lebensräume herangezogen. Dies gilt insbesondere auch für Napfschnecken“, betont Dallinger.
Gabriele Rampl
Förderungen
Gefördert wurden diese Forschungen unter anderem vom österreichischen Wissenschaftsfonds FWF (DACH-Projekt No. I 1482-N28, Leading Agency FWF, Projektleiter: Reinhard Dallinger; Projekt No. P 33973-B, Projektleiter: Reinhard Dallinger und Veronika Pedrini-Martha). Die Gruppe des Umweltwissenschaftlers am Institut für Zoologie der Universität Innsbruck arbeitet multidisziplinär mit zahlreichen Instituten und Arbeitsgruppen aus Österreich, Spanien, Deutschland und der Schweiz zusammen.
Publikation
García-Risco M., Calatayud S., Pedrini-Martha V., Albalat R., Palacios Ò., Capdevila M. & Dallinger R. A de novo evolved domain improves the cadmium detoxification capacitiy of limpet metallothioneins. Sci Rep 13(1) 8895 (2023). DOI: 10.1038/s41598-023-35786-1


