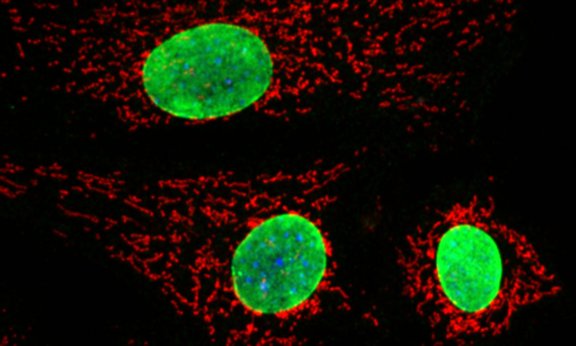
„Die Frage, warum Zellen altern, ist leider nicht einfach zu beantworten. Es gibt viele verschiedene Gründe dafür“, erklärt Alexander Weiss. „Unter anderem können negative Umwelteinflüsse unsere Zellen beeinträchtigen. Zum Beispiel können UV-Licht und manche Chemikalien permanente Schäden in unserem Erbgut, der DNA, verursachen.“ Der studierte Chemiker leitet seit 2020 eine Arbeitsgruppe am Innsbrucker Forschungsinstitut für Biomedizinische Alternsforschung und beschäftigt sich bereits seit einigen Jahren – unter anderem in der Forschungsgruppe von Dr. Pidder Jansen-Dürr – mit einzelnen Faktoren der Zellalterung. „Mitochondrien, Organellen in unseren Zellen, spielen eine zentrale Rolle im Metabolismus. Sie übernehmen viele wichtigen Aufgaben innerhalb der Zelle, und sind unter anderem in der Lage, ein Molekül namens Adenosintriphosphat (ATP) zu produzieren“, erklärt der Alternsforscher. „ATP vergleiche ich gerne mit der Euromünze im Euroraum, denn die im ATP gespeicherte Energie kann in Zellen universell und unmittelbar eingesetzt werden.“ Unterschiedlichste Fehler in den mitochondrialen Prozessen können zu Schäden innerhalb der Zelle und letztendlich zu uns allgemein bekannten Alterserscheinungen und Krankheiten führen. Chronische Störungen in den Mitochondrien können an der Entstehung verschiedener vererbter, aber auch alterungsbedingter Erkrankungen beteiligt sein.
ATP – Die Währung der Zelle: Adenosintriphosphat (ATP) ist ein universeller und unmittelbar verfügbarer molekularer Energieträger in Zellen. Produziert wird ATP von Mitochondrien, durch Phoysphorylierung von Adenosindiphosphat (ADP).
Schäden in den Mitochondrien
„Wenn eine Zelle Schäden akkumuliert, dann ist es im besten Fall so, dass ihre Reparaturmechanismen zum Einsatz kommen, oder die Zelle abstirbt“, erklärt Alexander Weiss. Funktioniert dies aus verschiedensten Gründen nicht, können möglicherweise Krebszellen entstehen, oder die Zelle kommt in ein sogenanntes seneszentes Stadium – sie ändert ihren Metabolismus, teilt sich nicht mehr, stirbt aber auch nicht ab. „Normalerweise wird in den Mitochondrien Sauerstoff zu Wasser reduziert. Bei diesem Prozess können aber auch sogenannte reaktive Sauerstoffspezies entstehen, die unter Umständen zu Zellschäden führen“, erläutert Weiss. Neben möglichen DNA-Schäden und reaktiven Sauerstoffspezies gibt es allerdings noch einen dritten Aspekt, der zum Altern von Zellen führen kann – die mitochondriale Dysfunktion, ein Themenbereich der in den letzten Jahren immer stärker in den Fokus der Alternsforschung gerückt ist. „Abseits der Produktion von reaktiven Sauerstoffspezies können in Mitochondrien auch noch andere Prozesse passieren, die letztendlich zur Seneszenz von Zellen führen können. Uns interessiert, was mit der Zelle passiert, wenn solche Schäden in den Mitochondrien auftreten und wie man diese eventuell reparieren kann“, erklärt Weiss. „Defekte in Mitochondrien können durch viele Prozesse auch wieder behoben werden, wie zum Beispiel durch Mitophagie – ein Reparaturmechanismen der Mitochondrien – oder durch die Substitution mancher Moleküle wie NAD+.“ Als Teil dieser Arbeit konzentriert sich Alexander Weiss mit seiner Forschungsgruppe im Speziellen auf das Protein FAHD1, das in den Mitochondrien eine regulative Rolle einnimmt. „Wir konnten zeigen, dass menschliche Zellen seneszent werden, wenn wir ihnen ihr FAHD1 wegnehmen“, erläutert der Alternsforscher. „FAHD1 ist also, ganz einfach gesagt, vergleichbar mit einem Schalter, den wir in unseren Versuchen umlegen können, um Seneszenz in Zellen auszulösen. Über einen kurzen Zeitraum bleibt der Schaden temporär und kann durch Aktivieren des Proteins wieder behoben werden.“ Neben der Struktur-Funktion und Charakterisierung des Proteins, arbeiten die Alternsforscher dabei unter anderem auch mit einer Methode, bei der sie den Zellen bei ihrer Zellatmung zuschauen können, der Respirometrie.
Krebszell-Teilung abschalten
Abgesehen von der Grundlagenforschung an FAHD1, arbeiten die Forscher um Alexander Weiss an möglichen Anwendungsgebieten. Gemeinsam mit seinem Team beschäftigt er sich mit Möglichkeiten, die Aktivität des Enzyms zu verändern. „Auch wenn es auf den ersten Blick vielleicht seltsam erscheint, ein für die Zelle wichtiges Protein deaktivieren zu wollen, so gibt es ja auch Zellen, die wir gezielt daran hindern wollen sich zu teilen, zum Beispiel Krebszellen. Da wir sehen, dass FAHD1 in gesunden Zellen eine wesentliche Rolle für das Wachstum der Zellen spielt, könnte sein Abschalten in Krebszellen einen Ansatz der Therapie bieten“, beschreibt er einen Fokus seiner künftigen Arbeit. Ein anderer Ansatz, den der Alternsforscher verfolgt, ist, chemische Inhibitoren für das Protein FAHD1 zu entwickeln. Der Nachwuchswissenschaftler will aber auch untersuchen, wie weitere Varianten von FAHD1 funktionieren, die in verschiedenen Tieren gefunden wurden. Auch die Rolle des bisher noch relativ unbekannten Proteins FAHD2, das ebenfalls in Mitochondrien nachgewiesen wurde, stehen auf der Liste seiner zukünftigen Forschungsvorhaben.
Zur Person
Mag. Dr. Alexander Weiss, geboren 1986 in Rum, studierte Chemie an der Universität Innsbruck und promovierte 2013 in Theoretischer Chemie mit einer Arbeit zu numerischen Modellen in computergestützten Simulationen und Quantenmechanik. 2015 wechselte er seine Forschungsdisziplin und an das Forschungsinstitut für Biomedizinische Alternsforschung, wo er einige Jahre in der Arbeitsgruppe von Pidder Jansen-Dürr als wissenschaftlicher Mitarbeiter tätig war und seit 2020 eine eigene Arbeitsgruppe leitet.
Dieser Artikel ist in der Juni-Ausgabe des Forschungsmagazins Zukunft Forschung erschienen. Eine digitale Version ist hier zu finden: www.uibk.ac.at/newsroom/zukunft-forschung-juni-2021.html.de