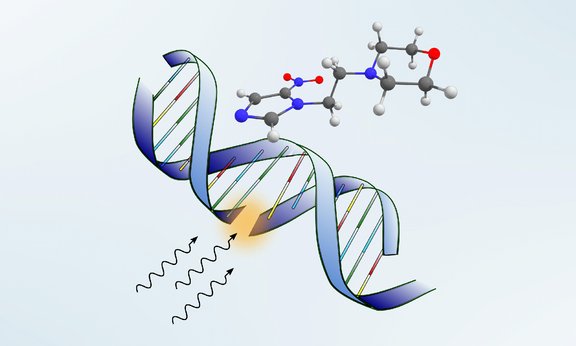
Schon Anfang des 19. Jahrhunderts wurde vom Wiener Radiologen Gottwald Schwarz erkannt, dass der überlebenswichtige Sauerstoff in Zellen deren Schädigung durch Röntgenstrahlung fördert. Durch diese Eigenschaft entsteht eine paradoxe Situation für die Bekämpfung von Krebstumoren in der Strahlentherapie, da Tumore aufgrund ihres enthemmten Wachstums Bereiche bilden, in denen eine ausgeprägte Sauerstoffarmut herrscht; diese Regionen sprechen aber durch den fehlenden Sauerstoff schlechter auf die Strahlung an als gesundes Gewebe. Um diesen Effekt aufzuheben, werden in der Krebsmedizin verschiedene Moleküle getestet, welche die Wirkung von Sauerstoff in sauerstoffarmen Tumoren imitieren soll. Ein Molekül, das erfolgreich in klinischen Studien getestet wurde, ist das Nimorazol-Molekül. Das in der Medizin sonst als Antibiotikum verwendete Medikament wird in Dänemark mittlerweile bei der Bekämpfung von Rachen- und Kehlkopftumoren in der Strahlentherapie eingesetzt. Der exakte Wirkungsmechanismus auf der molekularen Ebene ist allerdings unbekannt und beruht auf Hypothesen, die auf eine Bestätigung warten.
Elektronen werden eingefangen
Die Innsbrucker Forscher untersuchten in Zusammenarbeit mit Forscherteams aus vier Ländern die Frage, ob langsame Elektronen, die durch die Bestrahlung im Tumorgewebe freigesetzt werden, eine Rolle für die Wirkung des Moleküls spielen. „Die Experimente mit einzelnen Molekülen zeigten, dass Nimorazol langsame Elektronen außergewöhnlich effizient einfängt. Das Molekül zeichnet sich danach auch durch große Stabilität aus, indem es intakt bleibt“, erzählt Rebecca Meißner, die Erstautorin der in Nature Communications veröffentlichten Arbeit. „Sonst spalten Moleküle sich häufig auf, sobald ein freies Elektron eingefangen wird.“ In weiteren Experimenten haben die Wissenschaftler den Einfluss der Zellumgebung näherungsweise simuliert, indem sie Nimorazol mit Wassermolekülen umgaben. „Die Resultate zeigten, dass das Einfangen der Elektronen in dieser komplexeren Umgebung noch verstärkt wird“, schildert Projektleiter Stephan Denifl vom Institut für Ionenphysik und Angewandte Physik der Universität Innsbruck.
Empfindlichkeit von Tumorgewebe steigern
Diese Ergebnisse liefern einen Hinweis, warum der Wirkstoff speziell zur Strahlentherapie von sauerstoffarmen Tumoren eingesetzt werden kann. Das Molekül mit dem eingefangenen Elektron stellt selbst ein Radikal dar, das sich an die durch Strahlung geschädigte DNA bindet und dadurch zelleigene Reparaturmechanismen in Tumorzellen verhindert. In anderen Zellen, wo aber genügend Sauerstoff vorhanden ist, gibt das Nimorazol das eingefangene Elektron wieder an den Sauerstoff ab und wird dadurch recycelt. Damit ist eine Anreicherung des notwendigen Radikals in den sauerstoffarmen Zellen erzielbar und es wird die mangelnde Sensitivität gegenüber der Strahlung vermindert.
Diese Studie zeigt auch Perspektiven für das zukünftige Design von Molekülen auf, um die Sensitivität von Tumorgewebe zu verbessern. „Durch entsprechende Wahl der molekularen Struktur ließe sich die Effizienz des Elektroneneinfangens noch weiter optimieren“ meint Stephan Denifl. „Dabei dürfen aber natürlich auch nicht die biochemischen und pharmazeutischen Eigenschaften außer Acht gelassen werden.“
Der österreichische Wissenschaftsfonds FWF hat die Arbeit finanziell unterstützt.
Links
- Low-energy electrons transform the nimorazole molecule into a radiosensitiser. Rebecca Meißner, Jaroslav Kočišek, Linda Feketeová , Juraj Fedor, Michal Fárník, Paulo Limão-Vieira, Eugen Illenberger & Stephan Denifl. Nature Communications 10, 2388 (2019)
- Arbeitsgruppe Inelastische Elektronenstreuung, Institut für Ionenphysik und Angewandte Physik