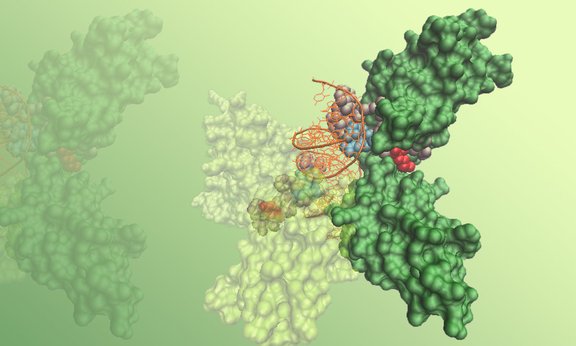
In der Regulation der Immunantwort spielt der Transkriptionsfaktor NF-κB eine zentrale Rolle. Die Bezeichnung NF-κB ist ein Sammelbegriff für eine Familie von Signalproteinen, die auch als Rel-Familie bekannt sind. In Säugetieren existieren fünf bekannte Untereinheiten. Die Aktivierung dieser, gleichsam als Entzündungsschalter fungierenden Protein-Familie und deren Genregulation wird mit der Entstehung von Autoimmun-, aber auch Krebserkrankungen in Verbindung gebracht und ist deshalb weltweit Gegenstand intensiver Forschung.
Enzym als neues, immunmodulierendes Angriffsziel
Die aus einer Forschungskooperation zwischen der Sektion für Zellbiologie und der Sektion für Klinische Biochemie des Biozentrums sowie der Sektion für Theoretische Chemie des Instituts für Allgemeine, Anorganische und Theoretische Chemie der Universität Innsbruck hervorgegangene und in dieser Woche in den Proceedings of the National Academy of Sciences veröffentlichte Forschungsarbeit entlarvt nun einen neuen, hemmenden Mechanismus, welcher die – zeitlich limitierte – NF-κB-Aktivierung über das proinflammatorische Zytokin TNF-α reguliert. „In unseren Untersuchungen konnten wir zeigen“, so der aus der Ukraine stammende und seit zwei Jahren im Team um Prof. Lukas A. Huber forschende Studienleiter PD Dr. Taras Valovka, „dass ein Enzym mit dem Namen Protein Arginine Methyltransferase 1 (PRMT1) die Expression inflammatorischer Gene kontrolliert, indem es zwei Methylgruppen, asymmetrisch, an eine bestimme Aminosäure der transaktivierenden Untereinheit von NF-κB anhängt.“ Diese posttranslationale Modifikation von NF-κB unterdrückt die DNA-Bindungsaktivität und verhindert somit die Genexpression. Inwieweit sich PRMT1 vor diesem Hintergrund als vielversprechendes Angriffsziel zur Eindämmung der NF-κB induzierten, überschießenden Immunantwort eignet, sollen nun weitere Forschungen zeigen.
Erfolgreiche Zusammenarbeit am Standort
„Neben der erstmaligen Darstellung dieses Entzündungsmechanismus ist es dank der interdisziplinären, von FWF und ÖAW unterstützen Zusammenarbeit und mit der Expertise der Teams um Prof. Lukas Huber, der Sektion für Klinische Biochemie um Prof. Herbert Lindner und der Sektion für Theoretische Chemie an der Universität Innsbruck unter Prof. Klaus Liedl außerdem gelungen, die dieser Regulation zugrunde liegenden molekularen Mechanismen im Detail aufzuklären und so zum besseren Verständnis NF-κB beteiligter Erkrankungen beizutragen“, betont Valovka. Klaus Liedl ergänzt: „Wir haben mittels struktureller Vorhersagen und anhand von Computersimulationen zum strukturellen Verständnis der beteiligten Interaktionen beigetragen. Insbesondere konnten wir die Erklärung für die Beeinflussung der Stabilität des DNA-NF-κB Komplexes durch Methylierung und Mutationen liefern.“