Genetische Erkrankung gewährt wichtige Einblicke in Sehprozess
Photorezeptoren, also jene Zellen in der Netzhaut, welche Lichtreize in elektrische Signale umwandeln, müssen im Dunklen sehr lang andauernde intrazelluläre Kalziumsignale erzeugen, um normales Sehen zu gewährleisten. Den ForscherInnen gelang es, einen molekularen Mechanismus zu identifizieren, der dies ermöglicht. Diese Entdeckung erfolgte im Rahmen der Analyse bekannter Mutationen in einem Kalziumkanalprotein, die als Ursache für eine erbliche Form von Nachtblindheit wie auch anderer Sehstörungen (Congenital Stationary Night Blindness Type 2, CSNB2) bekannt sind.
Entdeckung am Institut für Pharmazie
Kalziumionen dienen in vielen elektrisch erregbaren Zellen als Signalstoff. Bei Erregung von z.B. Muskel- oder Nervenzellen kann Kalzium durch sog. spannungsaktivierte Kalziumkanäle aus dem extrazellulären Raum ins Zellinnere einströmen und eine Kalzium-abhängige Zellantwort (wie etwa Muskelkontraktion oder Freisetzung von Hormonen oder von neuronalen Botenstoffen, sogenannten Neurotransmittern) auslösen. Da zuviel Kalziumeinstrom den Zellen schaden kann, besitzen Kalziumkanäle einen empfindlichen Mechanismus, mit dem sie sich bei lang andauernder Stimulation selbst inaktivieren ("Kalzium-induzierte Inaktivierung"). Schon vor drei Jahren entdeckte Dr. Alexandra Koschak in der Arbeitsgruppe von Univ.-Prof. Dr. Jörg Striessnig (Institut für Pharmazie, Centrum für Molekulare Biowissenschaften) diesbezüglich eine Ausnahme, nämlich Kalziumkanäle in Photorezeptoren der Netzhaut. Fehlende Kalzium-induzierte Inaktivierung ist hier physiologisch sehr sinnvoll, denn ein lang anhaltender Kalziumeinstrom ist in Photorezeptoren nötig, um eine kontinuierliche Freisetzung des Neurotransmitters Glutamat zu ermöglichen. Mit zunehmender Helligkeit wird dieses Glutamatsignal abgeschwächt und bildet somit eine wichtige Grundlage für den Sehprozess.
Doktorandin identifiziert einen neuen Modulator
Anamika Singh gelang es nun im Rahmen ihrer Dissertation in derselben Arbeitsgruppe am Institut für Pharmazie, einen Modulator am Ende des aus ca. 2000 Aminosäuren bestehenden Kalziumkanalproteins zu identifizieren, welcher diese Kalzium-induzierte Inaktivierung verhindert. Fehlt dieser modulatorische Abschnitt, wie in einer bei CSNB2 Patienten vorkommenden Mutation, dann zeigte dieser mutierte Photorezeptor-Kalziumkanal ebenfalls Inaktivierung, wie andere Kalziumkanäle. Mittels fluoreszenzspektroskopischer Verfahren (FRET), die in Kollaboration mit der Arbeitsgruppe von A. Univ.-Prof. Dr. Christoph Romanin am Institut für Biophysik der Universität Linz durchgeführt wurden, gelang darüber hinaus die Identifikation anderer Regionen im Kalziumkanalprotein, welche mit diesem modulatorischen Abschnitt in Wechselwirkung treten und die Inaktivierung stören. Interessanterweise ist dieser modulatorische Effekt auch auf andere Kalziumkanäle übertragbar. Diese Beobachtung ist deshalb von Bedeutung, da hiermit ein neues pharmakologisches Prinzip für die Modulation von Kalziumkanälen beschrieben wird. Die Innsbrucker und Linzer Arbeitsgruppen wollen nun auch gemeinsam untersuchen, ob diese molekularen Details zur Entwicklung neuartiger Kalziumkanalmodulatoren genützt werden können. Für solche Wirkstoffe wird eine Reihe interessanter therapeutischer Effekte postuliert.
Abbildung:
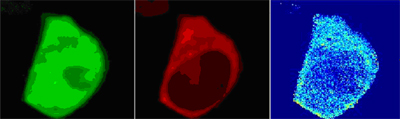
Zum Nachweis der Bindung des inhibitorischen modulatorischen Abschnitts (grün) an einen anderen Abschnitt im Kalziumkanalmolekül (rot) werden beide Proteine mit unterschiedlichen Farbmarkierungen versehen und künstlich in Zellkulturen menschlicher Säugerzellen eingeschleust. Nur wenn der modulatorische Abschnitt an den anderen Abschnitt bindet kommt es zu einer messbaren Wechselwirkung (FRET) zwischen den Farbstoffen, erkennbar als hellblaues bis gelbes Signal (rechts) in der untersuchten Zelle.