Atomares Puzzlespiel
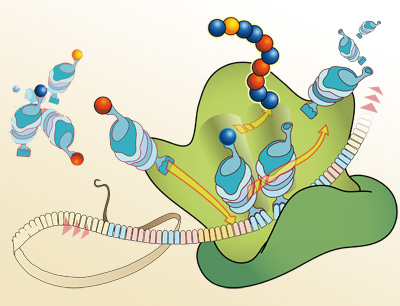
Sie gelten als die Proteinfabriken der Zelle: die Ribosomen. In diesen komplexen Strukturen aus Proteinen und Ribonukleinsäuren (RNA) werden auf Basis des genetischen Codes Aminosäuren miteinander verknüpft und auf diese Weise Proteine hergestellt. 2009 wurde für Studien zur Struktur und Funktion des Ribosoms der Chemie-Nobelpreis verliehen. Seither bemüht sich die Wissenschaftsgemeinde zum einen diese am bakteriellen Ribosom gewonnenen Erkenntnisse auf höhere Lebensformen auszuweiten, insbesondere auf menschliche Zellen. Andererseits richten die Forscherinnen und Forscher ihr Interesse auf eine große Zahl von Faktoren, die diesen Prozess regulieren. Wesentliche Beiträge dazu leisten die Forschungsgruppen um Prof. Norbert Polacek vom Departement für Chemie und Biochemie der Universität Bern und Prof. Ronald Micura vom Institut für Organische Chemie der Universität Innsbruck. Seit der Molekularbiologe Polacek in den 2000er-Jahren in Innsbruck tätig war, kooperieren die beiden Gruppen eng bei der Aufklärung der Funktionsweise von Ribosomen. Polacek schneidet dazu kleine Stücke der ribosomalen RNA gezielt heraus, und der organische Chemiker Micura stellt die passenden Ersatzteile her: künstliche Stücke ribosomaler RNA, die nur in einzelnen Atomen vom natürlichen Vorbild abweichen. Anschließend testen die Wissenschaftler, wie sich der Austausch einzelner Atome oder Atomgruppen auswirkt. „So können wir Vermutung, die sich bei der Strukturanalyse von Ribosomen ergeben, sehr gezielt untersuchen“, sagt Ronald Micura.
Mechanismus aufgeklärt
Nun haben die Wissenschaftler eine weitere für die Proteinbiosynthese wichtige Funktion charakterisiert. Sie berichten darüber in der Fachzeitschrift Proceedings of the National Academy of Sciences (PNAS). Es geht dabei um das „Förderband“ der Ribosom-Maschinerie, den Transport der Transfer-RNAs. Diese sind die Träger der Aminosäuren, die im Ribosom verknüpft werden. Wenn sie ihre „Fracht“ abgeliefert haben, machen sie rasch Platz für die nächsten, mit neuen Aminosäuren beladenen RNAs. Damit das Weiterrutschen der Transfer-RNAs funktioniert, muss eine chemische Reaktion am Ribosom stattfinden: die Hydrolyse des Energieträgers GTP an dem Enzym EF-G. Die Forscher haben nun durch das Austauschen einzelner Atome im Ribosom die essentielle Rolle einer bestimmten Struktureinheit bei der Hydrolyse aufgeklärt.
Für die Darstellung ihrer Beiträge zu dieser Arbeit wurde die Doktorandin Sara Flür beim Life Science Meeting in Innsbruck 2014 mit dem Best Poster Award ausgezeichnet. „Der Nachweis dieser funktionell wichtigen Position im Ribosom war sehr zeitraubend und aufwändig“, erzählt Micura. „Dank der ausgezeichneten gegenseitigen Vertrauensbasis mit unserem Kooperationspartner in Bern haben wir aber auch diese Durststrecken überwunden“, zeigt sich der Chemiker glücklich über die nun veröffentlichen Ergebnisse.