Kampf gegen Krebs auf molekularer Ebene verstehen
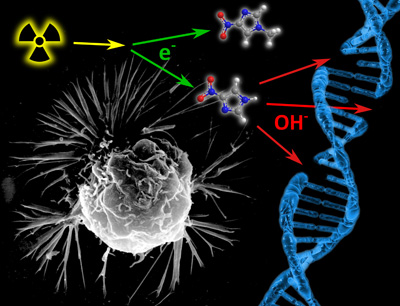
Bösartige Tumorzellen sind an Sauerstoffmangel sehr gut angepasst. Durch den Einsatz von Radiosensitizern soll der Sauerstoffgehalt im Krebsgewebe auf ein möglichst hohes Niveau gebracht werden, um dadurch die Empfindlichkeit entarteter Zellen auf ionisierende Strahlung zu erhöhen. Seit wenigen Jahren werden in diesem Kontext bestimmte Derivate der Nitroverbindung „Nitroimidazol“ (C3H3N3O2) erforscht. „Wir haben jetzt herausgefunden, dass es bei diesen Derivaten exakt auf die molekulare Struktur ankommen wird, ob Nitroimidazol durch langsame, sekundäre Elektronen zerstört wird oder nicht“, sagt Denifl. Diese Ergebnisse publizierte das Team nun in der Printausgabe der renommierten Fachzeitschrift Angewandte Chemie International Edition. Gefördert werden diese Forschungen vom österreichischen Wissenschaftsfonds FWF.
Brückenschlag zur Medizin wird intensiviert
Das Team hat im Zuge des jüngsten Experimentes in einer Spezialkammer Proben von 4-Nitroimidazol verdampft. Anschließend wurden diese Moleküle durch eine Kapillare geleitet und mit langsamen Elektronen beschossen. „Wie die massenspektrometrische Analyse der Reaktionsprodukte zeigt, tritt der Radiosensitizer in sehr starke Wechselwirkung mit langsamen Elektronen. Die Moleküle werden dabei zersetzt. Als Zerfallsprodukt entsteht eine ganze Reihe von Hydroxyl-Radikalen (OH), deren schädliche Wirkung auf unsere DNA bekannt ist“, betont der Ionenphysiker. Bei einem anderen bisher untersuchten Derivat von Nitroimidazol tritt anstelle der ursprünglichen Position eines Wasserstoff-Atoms eine Methyl-, also CH3-Gruppe. „Bereits diese Methylierung unterdrückt höchst überraschenderweise die komplette elektronen-induzierte Chemie und damit positive Effekte im möglichen Einsatz in der Radiochemotherapie“, erklärt der Forscher.
Aufgrund dieser unter anderem in Zusammenarbeit mit Dr.in Linda Feketeová vom Institut für Kernphysik im französischen Lyon jetzt erforschten Reaktionen plant das Innsbrucker Team die Untersuchung weiterer Nitroimidazol-Derivate und will dabei eng mit dänischen Medizinern rund um Prof. Michael Horsman vom Universitätshospital in Aarhus zusammenarbeiten. „Die klinischen Tests in Aarhus ergaben je nach verwendetem Nitroimidazol-Derivat höchst unterschiedliche Behandlungserfolge. Dies ist ein weiterer Grund, warum wir die Sensitivierung gegenüber Bestrahlung auf molekularer Ebene verstehen wollen. Wir hoffen auch auf sehr lange Sicht, ein Molekül als neuen Radiosensitizer zu synthetisieren und dessen Effekte auf molekularer Ebene zu testen“, betont Denifl.
Der 37-Jährige leitet gemeinsam mit Prof. Paul Scheier die Arbeitsgruppe Nano-Bio-Physik am Institut für Ionen- und Angewandte Physik der Universität Innsbruck. Auf Basis international renommierter, langjähriger Grundlagenforschungen des früheren Institutsleiters und heutigen Rektors der Universität Innsbruck, Prof. Tilmann Märk, sorgt diese Gruppe immer wieder in der Erforschung der Rolle langsamer Elektronen bei der Entstehung von Strahlenschäden und Krebs sowie bei der damit eng verknüpften Rolle dieser Teilchen bei der Bildung erster, komplexer Biomoleküle im Weltall für internationales Aufsehen.
(Gabriele Rampl)