Auf der Suche nach dem passenden Wirkstoff
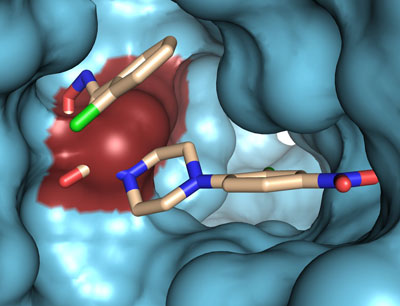
In der antiviralen Therapie des Influenza-Virus stellt die Neuraminidase eine wichtige pharmakologische Zielstruktur – ein sogenanntes Target – dar und viele am Markt verfügbaren Grippe-Medikamente zielen auf diese ab. „Die Neuraminidase – ein Oberflächenprotein des Virus – ist für die Abtrennung der Sialinsäure von der Wirtszelle verantwortlich und ermöglicht so die Freisetzung der reifen Viren und damit die Ausbreitung der Infektion“, erklärt Univ.-Prof. DDr. Klaus Liedl, Leiter des Instituts für Allgemeine, Anorganische und Theoretische Chemie. „Das derzeit wohl bekannteste Medikament gegen das Virus am Markt – Tamiflu – zielt auf dieses Target ab, indem es die Grippe-Neuraminidase blockiert. Dadurch kann das Virus sich nicht mehr vermehren.“ Ein großes Problem bei der Influenza-Therapie stellen allerdings Resistenzen dar, die die Viren gegen die Wirkstoffe entwickeln. „Die Proteine des Influenza-Virus sind flexibel in ihrer Zusammensetzung und in ihrer Struktur, diese Fähigkeit hilft dem Virus sich anzupassen und auch Resistenzen gegen Wirkstoffe zu entwickeln“, beschreibt Klaus Liedl, der im Rahmen eines vom Fonds zur Förderung der wissenschaftlichen Forschung (FWF) finanzierten Projekts neue Inhibitoren der Influenza-Neuraminidase finden will. Sein Spezialgebiet – die Proteinflexibilität – spielt bei dieser Suche eine wesentliche Rolle.
Flexible Strukturen
Beschränkten sich die Untersuchungen der einzelnen Proteine des Influenza-Virus bis vor wenigen Jahren noch auf starre Kristallstrukturen, ermöglichen es jüngste Forschungsergebnisse – unter anderem auch aus der Forschungsgruppe um Klaus Liedl – die Flexibilität der Proteine mittels umfangreicher Rechenmodelle darzustellen. Mithilfe dieser Modelle versuchen die Wissenschaftler nun einen Wirkstoff zu finden, der von seiner Struktur her optimal in das aktive Zentrum der Grippe-Neuraminidase passt. „Unser Ziel ist es, einen Wirkstoffkandidaten zu finden, der gar nicht in das aktive Zentrum der Neuraminidase – die Bindetasche – binden könnte, wenn diese durch die Flexibilität des Proteins nicht offen wäre“, beschreibt Liedl. Bei diesen Berechnungen bewegen die theoretischen Chemiker die Struktur des Proteins entlang der Kräfte, die auf diese Struktur wirken. „Wir sind in den High-Performance-Computing-Schwerpunkt der Universität Innsbruck eingebunden, wodurch wir optimale Bedingungen für unsere Berechnungen haben“, so Liedl. Der High-Performance-Rechner Leo-III, den die Wissenschaftler für ihr Forschungsprojekt verwenden, verfügt über eine Rechenleistung von ca. 20 Teraflops, 4 Terabyte RAM und 86 Terabyte Festplattenspeicher. „Auch mit diesem Gerät dauern unsere Berechnungen mitunter noch mehrere Wochen“, verdeutlicht Liedls Mitarbeiterin Susanne von Grafenstein die Komplexität der Rechenarbeit.
Nachdem die Wissenschaftler dank spezieller Rechenmodelle alle möglichen Strukturen des Proteins kennen, gleichen sie diese mit potentiellen Wirkstoffstrukturen ab, um zu sehen, welche Wirkstoffstruktur am besten in die Bindetasche der Neuraminidase passen würde. In der Folge schlagen sie in Zusammenarbeit mit Prof. Judith Rollinger vom Institut für Pharmazie der Uni Innsbruck mögliche Pflanzenstoffe vor, lassen Stoffe synthetisieren oder kaufen diese. „Die erfolgversprechendsten Kandidaten schicken wir dann an unsere Projektpartnerin, die Virologin Dr. Michaela Schmidtke am Universitätsklinikum in Jena, die die möglichen Wirkstoffe dann an verschiedenen Systemen testet“, beschreibt Liedl den Ablauf.
Mehrfachwirkstoff
Da Neuraminidasen nicht nur in Viren sondern auch in Bakterien vorkommen, hat die Forschungsgruppe um Klaus Liedl auch diese Zielstruktur in ihre Untersuchungen integriert. „Bei einer Grippe spielen oft auch bakterielle Zusatzinfektionen zum Beispiel der Atemwege eine große Rolle – aus diesem Grund wäre unser Ziel, einen Wirkstoffkandidaten zu finden, der sowohl die Neuraminidase des Influenza-Virus als auch die bakterielle Neuraminidase hemmt“, erklärt Susanne von Grafenstein. Eine Schwierigkeit dabei ist die Tatsache, dass auch im menschlichen Körper Neuraminidasen vorkommen, die beispielsweise bei der Gehirnentwicklung eine Rolle spielen. „Wir müssen bei der Suche also einen Wirkstoff finden, der die Neuraminidasen im Virus und im Bakterium inhibiert, auf die humane Neuraminidase allerdings keine oder nur eine sehr geringe Wirkung hat“, verdeutlicht die studierte Pharmazeutin Susanne von Grafenstein.
Angriffspunkte ausgeweitet
Neben den Untersuchungen zur Neuraminidase, haben die Wissenschaftler nun auch weitere Targets im Influenza-Virus in ihr Forschungsprojekt aufgenommen: „Das Influenza-Virus benötigt für seinen Lebenszyklus im wesentlichen drei Phasen: erstens ein Eindringen in die Wirtszelle, zweitens das Ausnutzen des Replikationsmechanismus der Zelle um sich zu vermehren, und drittens das Reifen und Abspalten der neuen Viren. Neben der Neuraminidase, die in der dritten Phase aktiv ist, haben wir noch zwei Targets aus den anderen Phasen in unser Projekt eingebunden: Nukleoprotein sowie Hämagglutinin – um ein möglichst breites Verständnis des Virus zu erhalten“, so Liedl. Das Nukleoprotein ist der Ort, wo das Virus seine RNA speichert und somit von großer Bedeutung für dessen Vermehrung ist. „Auch bei diesem Target – für das es noch keinen zugelassenen Wirkstoff gibt – versuchen wir, den Aspekt der Mutationen zu modellieren, was auch wesentlich zum Verständnis des Virus beiträgt“, so Liedl. Die dritte Zielstruktur, die die Wissenschaftler in ihrem Forschungsprojekt untersuchen, ist das Hämagglutinin. Dieses Protein spielt eine große Rolle, wenn ein Virus es schafft die Wirtsbarriere zu überschreiten, also zum Beispiel vom Vogelvirus zum Menschenvirus wird – ein Schritt, der im Bezug auf Pandemien sehr gefährlich ist. „Hämagglutinin ist im Virus dafür verantwortlich, dass das Virus in der Wirtszelle andocken und für die Vermehrung in die Zelle eindringt – um die Wirtsbarriere zu überwinden, muss dieses Enzym sich anpassen“, erklärt Klaus Liedl. „Wenn wir diese Anpassungsfähigkeit besser verstehen, können wir besser entscheiden von welchen Viren größere Gefahren für die Menschen ausgehen.
Wichtiges Basiswissen
Auch wenn die Wissenschaftler bereits einige sehr erfolgsversprechende Wirkstoff-Kandidaten gefunden haben, ist der Weg zum zugelassenen Medikament noch weit. „Unsere Forschungsarbeit ist Grundlagenforschung, die wichtiges Basiswissen für die Pharmaindustrie liefert“, so Liedl. Aber auch wenn die Entwicklung eines neuen Medikaments gegen das Grippe-Virus noch vieler weiterer Schritte bedarf, haben die Forschungen der Gruppe um den Chemiker bereits jetzt sehr viele Ergebnisse geliefert, die für das Verständnis und damit auch die Bekämpfung des Virus von entscheidender Bedeutung sind.
Dieser Artikel ist in der Dezember-Ausgabe des Magazins „wissenswert“ erschienen. Eine digitale Version ist hier zu finden (PDF).